血栓形成是主要不良心血管事件(MACEs)导致死亡和残疾的主要原因。许多病理状况,如COVID-19和代谢紊乱可导致血栓形成风险增加;然而,潜在的机制仍然知之甚少。
2024年2月23日,中山大学陈思凡、任萌及广州医科大学李凌华共同通讯在Cell Metabolism 在线发表题为“Gut microbial co-metabolite 2-methylbutyrylcarnitine exacerbates thrombosis via binding to and activating integrin α2β1”的研究论文,该研究表明肠道微生物共同代谢物二甲基丁酰基肉碱通过结合和激活整合素α2β1加剧血栓形成。该研究表明,二甲基丁酰基肉碱(2MBC)是一种支链酰基肉碱,在COVID-19患者和MACEs患者中积累。2MBC增强小鼠血小板高反应性和血栓形成。
在机制上,2MBC与血小板中的整合素α2β1结合,增强胞质磷脂酶A2 (cPLA2)的激活和血小板的高反应性。基因缺失或整合素α2β1的药理抑制在很大程度上逆转了2MBC的促血栓作用。值得注意的是,2MBC可以以肠道微生物依赖的方式产生,而血浆2MBC的积累及其血栓形成加重作用在抗生素诱导的微生物耗尽后得到很大程度的改善。该研究表明2MBC是一种代谢物,将肠道微生物群失调与血栓形成风险升高联系起来,为血栓形成提供了机制和潜在的治疗策略。

血栓形成是主要不良心血管事件(即心肌梗死、缺血性中风和肺栓塞)导致死亡和残疾的主要原因。血小板高反应性是导致血栓形成和弥散性缺血的重要因素之一。越来越多的证据证明,在许多情况下,如糖尿病、肥胖、高脂血症、高血压或病毒感染,血小板的高反应性功能反应。例如,2019冠状病毒病的爆发导致血栓事件急剧增加。值得注意的是,血小板的高反应性及其相关的血栓负担增加不仅存在于急性期,甚至在病毒清除后仍然存在,强调未公开的非经典途径,不同于病毒攻击或急性炎症反应,可能参与血小板活性的调节。因此,对COVID-19患者的研究将有助于确定促成血栓形成的新机制。
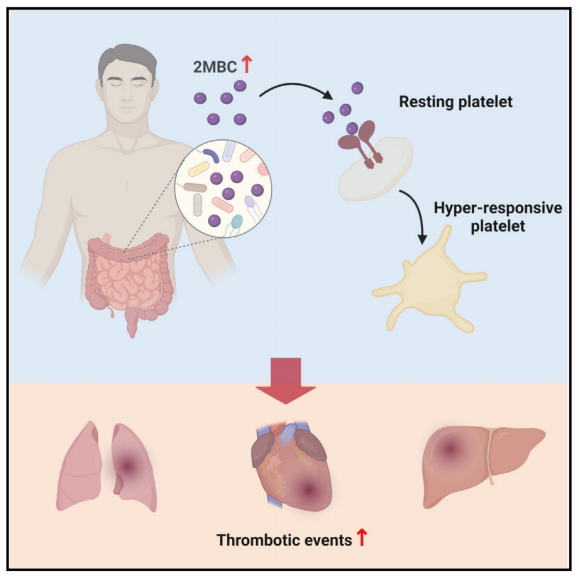
模式图(Credit: Cell Metabolism)
大量证据表明,肠道菌群失调与血栓形成可能性升高之间存在关联。正如先前报道的那样,肠道微生物衍生的代谢物,即三甲胺-N-氧化物(TMAO)和苯乙酰谷氨酰胺(PAGln),可以增加血小板活性和血栓形成,以及心血管疾病的风险。尽管在与血栓形成风险升高相关的COVID-19和代谢紊乱患者中,肠道微生物群失调已经得到了大量描述,但它们之间的因果关系和导致血栓形成并发症的机制仍然知之甚少。
该研究进行了多代谢组学分析,并确定了2MBC,一种短支链酰基肉碱,作为一种关键的宿主和肠道微生物共同代谢物,有助于提高血栓形成风险。研究表明,2MBC通过直接结合整合素α2β1促进血小板高反应性,而基因缺失或整合素α2β1的药理抑制足以改善2MBC诱导的血栓形成电位升高。这项研究确定了2MBC是一种连接肠道微生物群失调和血栓形成风险增加的中间代谢物,为血栓形成事件提供了新的机制见解和潜在的治疗策略。
原文链接https://www.cell.com/cell-metabolism/abstract/S1550-4131(24)00014-7













